Das Orbitalmodell
In diesem Kapitel erkläre ich Dir das Orbitalmodell. Dabei handelt es sich um ein Modell, welches auf den Erkenntnissen von Rutherford und Bohr basiert und zudem einige Erkenntnisse der Quantenmechanik berücksichtigt.
Zunächst ein Hinweis: Es sinnvoll, dass Du schon die Kapitel der beiden Atommodelle von Rutherford und Bohr gelesen hast.
Das Modell
Zu Beginn des 20. Jahrhunderts haben kluge Köpfe wie Albert Einstein, Werner Heisenberg und Erwin Schrödinger wichtige Erkenntnisse im Bereich der Quantenmechanik - einem Teilgebiet der Physik - errungen. Durch ihre Erkenntnisse konnten unter anderem die bisherigen Atommodelle verbessert werden. Im nun Folgenden soll dabei auf die Grundgedanken des Orbitalmodellseingegangen werden. Auf die komplexen mathematischen Hintergründe soll hier hingegen nicht eingegangen werden. Stattdessen soll eine Grundvorstellung des Modells vermittelt werden.
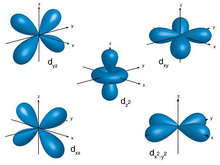
Aufenthalsbereich als Kugeln:
Im Orbitalmodell stellt man sich den Aufenthaltsbereich aller Elektronen als Kugeln vor. Und auch wenn es seltsam klingt: Man weiß nicht genau, wo sich die Elektronen in dieser Kugel
befinden. Dieses Phänomen wird als Heisenbergsche Unschärferelation bezeichnet und wurde vom Nobelpreisträger Werner Karl Heisenberg aufgestellt. Es besagt, dass
bestimmte Messgrößen eines Teilchens nicht gleichzeitig beliebig genau bestimmt werden können.
Man kann sich das allerdings auch etwas einfacher erklären: Stellt euch eine nervende Mücke vor, die sich nachts um eure Lampe bewegt. Das Licht der Lampe zieht die Mücke in ihren Bann und lässt
sie näher kommen. Durch die Hitze der Lampe hingegen, wird die Mücke jedoch etwas auf Abstand gehalten. Der kleine Plagegeist fliegt also in einigen Zentimeter Abstand um die Lampe umher. Wo
genau, wisst ihr nicht. Nur halt, dass sie in der Nähe der Lampe ist. So ist es auch mit dem Elektron: Man weißt recht gut in welchem Bereich es sein muss, jedoch die wirklich genaue Position ist
nicht zu erkennen.
Kugelzahl und Spin
Die Anzahl der Kugel ist von der Größe der jeweiligen Schale abhängig. Auf der ersten Schale ist Platz für eine Kugel, auf der zweiten für vier Kugeln. Nach außen hin steigt somit der Platz. Jede einzelne Kugel hat Platz für maximal zwei Elektronen. Jedes Elektron hat einen "Drall", auch Spin genannt. Innerhalb einer Kugelwolke besitzen die beiden Elektronen entgegengesetzten Spin, sie bewegen sich also in entgegengesetzter Richtung. Dies ist auch der Grund, warum nur zwei Elektronen pro Kugel Platz haben.
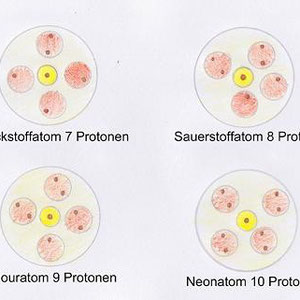
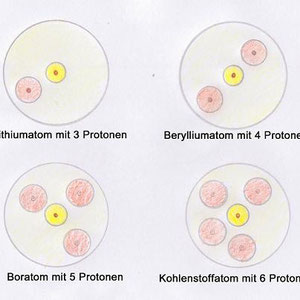
Dies soll nun anhand von einigen Beispielen noch einleuchtender werden. Dabei betrachten wir zunächst das erste Element des Periodensystems der Elemente (Periodensystem in neuem Fenster anzeigen). Es handelt sich dabei um Wasserstoff ( H ). Das Wasserstoff hat ein Proton im Kern und ein Elektron in der Hülle. Beim Helium ( He ) sind es zwei Protonen im Kern und zwei in der Hülle. Soweit eigentlich nichts ungewöhnliches.
Interessant wird es nun, wenn die innerste Schale vollständig gefüllt ist, was bei 2 Elektronen ( also beim Helium bereits ) der Fall ist. Ab dann wird die zweite Schale besetzt. Die folgenden Grafiken verdeutlichen dies besser als Text. Soviel sei jedoch gesagt: Die nachfolgenden 8 Elemente (Lithium bis Neon) besitzen Elektronen in der zweiten Schale. Dabei werden die Kugeln nach und nach erst mit einem Elektron gefüllt und sobald alle 4 Kugeln je 1 Elektron haben, wird ein zweites eingebracht. In der dritten Schale beginnt dieser Prozess mit aufsteigender Elektronenzahl von vorne.
Hinweis: Die Anzahl der Elektronen und Protonen sind bei den Elementen gleich.
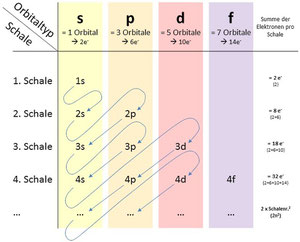
Das Auffüllen der Elektronen auf die verschiedenen Schalen und Orbits veranschaulicht die nebenestehende Grafik sehr schön.